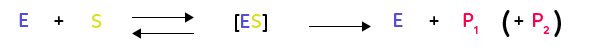Catalyse enzymatique et apport de glucose sanguin
L’apport en sucre dans l’organisme se fait principalement par l’alimentation. L’amidon notamment se trouve dans de nombreux aliments. Il s’agit toutefois d’un glucide complexe, un polymère, qui a besoin d’être découpé en petits morceaux, les monomères de glucose, avant d’être distribués aux organes par la circulation sanguine. La réaction biochimique qui effectue ce découpage s’appelle l’hydrolyse.
L’hydrolyse requière cependant pour se réaliser in vivo un milieu d’une température nettement supérieure à celle du corps humain, qui se situe seulement autour de 37°C. Ce sont des protéines, les enzymes, qui agissent comme catalyseurs et permettent l’hydrolyse.
Les enzymes présentent par ailleurs une double spécificité :
– une spécificité de substrat : l’enzyme n’est capable d’agir que sur un seul substrat. Par exemple seule l’enzyme amylase est capable d’agir sur l’amidon,
– une spécificité d’action : l’enzyme n’est capable d’effectuer qu’une seule action. Par exemple, l’amylase est seulement capable de transformer l’amidon en glucoses.
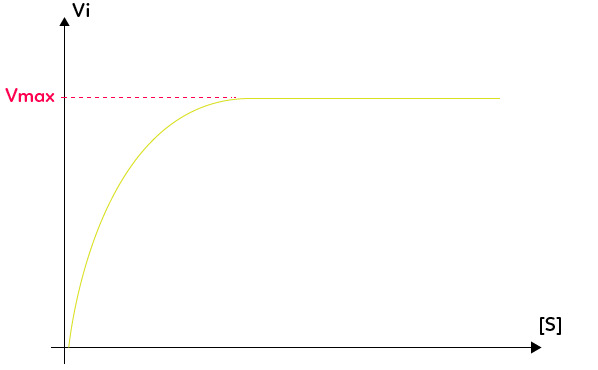
Si on suit expérimentalement la vitesse de la catalyse enzymatique en fonction de la concentration en substrat (on pourrait également suivre en fonction de la concentration en enzyme), on observe que lorsque la concentration de substrat dans le milieu augmente, alors la vitesse de la réaction augmente. Toutefois, cette augmentation de la vitesse de réaction n’est pas indéfinie, il y a un seuil, une vitesse maximale au-delà de laquelle on ne peut aller.
De ces observations et de celles de la double spécificité (de substrat et d’action), on a pu déduire qu’il existait une complémentarité spatiale entre l’enzyme et son substrat. Les deux molécules, du fait d’une forme tridimensionnelle complémentaire s’imbriquent l’une dans l’autre. On peut alors écrire la modélisation suivante :
L’enzyme et le substrat forment effectivement un complexe enzyme-substrat (noté ci-dessus [ES]), qui permet à la catalyse d’avoir lieu. À la fin de la réaction, on retrouve alors l’enzyme intacte en plus du ou des produits. Il s’agit alors d’une autre particularité des réactions enzymatiques, les enzymes sont conservées intactes lors des réactions (elles sont ainsi bien des catalyseurs, ne réagissant pas directement), et peuvent donc être réutilisées.
On peut également modéliser une catalyse enzymatique de la façon suivante :
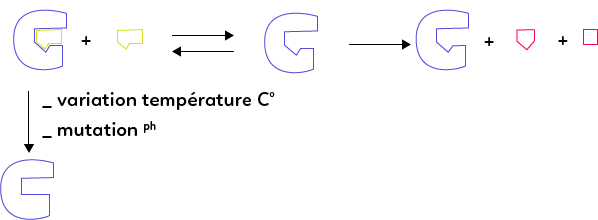
L’enzyme, représentée ici en bleu, possède une zone particulière composée de quelques acides aminés, appelée site actif de l’enzyme (qui a généralement la forme d’une poche) auprès duquel vient se fixer momentanément le substrat, et dans lequel la catalyse a lieu. On comprend donc l’importance première de la conformation (= forme) de l’enzyme. Cette forme en effet, obtenue lors de la maturation de l’enzyme, permet d’isoler et de protéger le site actif, de le conserver et de l’isoler du milieu dans lequel évolue l’enzyme.
Si l’enzyme venait à changer de conformation, alors le site actif pourrait ne plus être fonctionnel. Il existe un certain nombre de facteurs qui peuvent faire varier la conformation de l’enzyme, notamment :
– la variation de la température ;
– la variation du pH ;
– l’apparition d’une mutation génétique qui modifie la séquence d’ADN et à son tour éventuellement la séquence d’acides aminés correspondant à la protéine enzymatique, ce qui pourrait donc avoir un impact sur la conformation de l’enzyme.
Si les conditions du milieu dans lequel évolue l’enzyme sont modifiées (température ou pH), ou si une mutation génétique a lieu, alors l’enzyme se trouve partiellement ou totalement dénaturée, sa conformation change. Elle n’est alors plus capable d’accueillir le substrat et donc de catalyser la réaction.