Le répertoire immunitaire d'un individu
Le répertoire immunitaire d’un individu fait référence à des cellules de son système immunitaire. Les principales cellules impliquées dans les réactions immunitaires spécifiques sont les lymphocytes.
I. Le répertoire des lymphocytes B
Le répertoire des lymphocytes B est l’ensemble des lymphocytes B que possède un individu a un moment de sa vie. Chaque individu est capable de produire de nombreux anticorps différents. Ces anticorps sont produits par des plasmocytes et se trouvent également à la surface des lymphocytes B. Chaque anticorps est une protéine. Si notre corps est capable de produire des milliards de protéines différentes, il y a forcément un mécanisme génétique complexe derrière, puisque le génome humain n’est constitué que d’environ 25 000 gènes. On a donc 25 000 gènes pour construire un humain en entier et des milliards d’anticorps différents produits grâce à des gènes. Ces mécanismes génétiques sont complexes et s’appuient sur des recombinaisons génétiques aléatoires. Les lymphocytes B et T sont produits dans la moelle osseuse.
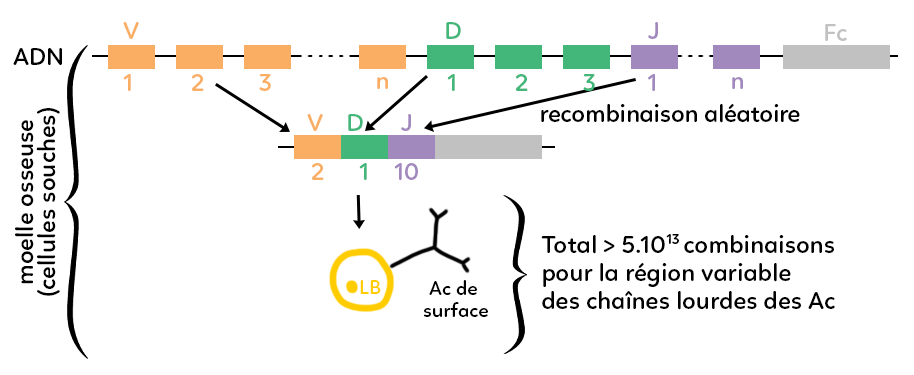
On a représenté un brin d’ADN donc un gène complexe qui code pour une partie d’un anticorps. On voit un gène divisé en plusieurs sous-unités. Les sous unités marchent par famille et on a représenté trois familles : la famille V en orange, D et en vert et J en violet. Finalement, on a représenté un fragment en gris qu’on note pour coder le fragment constant des anticorps.
La production d’un anticorps repose sur la formation de chaînes lourdes (deux chaînes lourdes identiques) et de chaînes légères. On a choisi de schématiser le gène qui code pour une chaîne lourde d’anticorps. Avant que l’ADN soit transcrit en ARN puis traduit en protéines anticorps, il y a une recombinaison :
on ne peut utiliser que certains fragments parmi tous ceux disponibles. On utilise une combinaison de certains fragments qui sera la combinaison propre à l’anticorps qu’on est en train de former.
Par exemple, parmi tous les fragments représentés, on a sélectionné le fragment orange V2, le fragment vert D1 et le fragment violet J10 plus le fragment constant. Cela donne une combinaison originale que l’on transcrit ensuite en ARN puis en protéine au niveau d’un anticorps et qui donnera un anticorps dont le fragment constant est représenté en gris et les fragments variables sont représentés en orange, vert et violet. La combinaison de ces trois fragments donnera une forme particulière puisque chaque anticorps est déterminé et caractérisé par la forme tridimensionnelle que prend sa partie variable. Il y a deux sites variables identiques qui correspondent aux sites de fixation éventuels avec un antigène. Autrement dit, la diversité des anticorps qui repose sur la diversité de leurs sites variables, repose elle-même sur des mécanismes complexes de recombinaison aléatoire génétiques qui font qu’à partir d’un gène morcelé en différents fragments, on ne va utiliser, pour la production d’un anticorps, que certains fragments et pas d’autres. En produisant un certain nombre de combinaisons différentes de fragments, on peut aboutir à différents anticorps qui auront des parties variables toutes différentes les unes des autres.
On a représenté sur le schéma un lymphocyte B qui porte un anticorps de surface avec sa partie variable en deux exemplaires. Au total, on considère qu’il y a plus de 5.1013 combinaisons possibles pour la région variable uniquement des chaînes lourdes des anticorps, c’est-à-dire l’immense variabilité de l’immense variété d’anticorps possibles que le corps d’un individu peut former.
Cette production est aléatoire. Grâce à la combinaison de certains fragments des gènes, on peut former des pré lymphocytes B. Parmi ces lymphocytes B, certains ont des formes non adaptées à la reconnaissance d’antigènes mais qui, au contraire, aléatoirement, correspondent à des formes reconnaissant des molécules du soi : ce sont des lymphocytes ou des anticorps auto-réactifs. Au lieu de permettre de reconnaître et donc de se défendre contre des molécules extérieures (pathogènes, antigènes), ils sont dirigés contre des molécules du soi. Ces anticorps et lymphocytes auto-réactifs constituent un danger pour l’organisme puisqu’ils pourraient être responsables de l’apparition de maladies auto-immunes. Dans ces maladies, le corps s’attaque aux propres molécules du soi et détruit, par son système immunitaire, quelques molécules ou quelques cellules de son propre organisme.
Au cours de leur maturation, ces pré lymphocytes B vont subir un tri et un phénomène d’apoptose. L’apoptose est la mort cellulaire programmée, comme un suicide cellulaire. On observe au cours de cette maturation, une apoptose des lymphocytes auto-réactifs. Après ce tri, il ne reste plus que des lymphocytes B immunocompétents, c’est-à-dire dirigés contre des molécules et des antigènes de non soi, qu’on appelle naïfs. Les lymphocytes naïfs sont des lymphocytes matures, prêts à agir mais qui n’ont pas encore rencontré d’antigène. Ils sont en stock dans l’organisme et celui-ci va pouvoir s’en servir si l’antigène contre lequel ils sont dirigés est rencontré (s’il pénètre dans notre corps). On a donc des lymphocytes B immunocompétents naïfs libérés, qui circulent dans le sang en sortant de la moelle osseuse.
II. Le répertoire des lymphocytes T
Les mécanismes de production des lymphocytes T sont assez comparables à ceux des lymphocytes B. Les lymphocytes T sont d’abord produits dans la moelle osseuse, comme les B, mais ensuite ils vont subir une maturation dans le thymus, un autre organe du système immunitaire. Comme pour les lymphocytes B, on a d’abord des pré-lymphocytes T qui vont subir un tri (on élimine les lymphocytes auto-réactifs) et une maturation. À l’issue de ce tri et de cette maturation, on récupère des lymphocytes T immunocompétents (dirigés contre du non soi), eux aussi naïfs puisqu’ils n’ont pas encore rencontré l’antigène et qui sont libérés dans le sang.
Résumé
Le répertoire immunitaire d’un individu est l’ensemble des milliards de lymphocytes B caractérisés par un anticorps de surface et des milliards de lymphocytes T caractérisés par leur récepteur T en surface que possède un individu. Ces lymphocytes B et T sont immunocompétents, capables de s’attaquer aux molécules du non soi et sont donc compétents pour défendre notre organisme, mais ils sont encore naïfs puisqu’ils ne deviendront actifs et effecteurs de réaction immunitaire qu’après la rencontre effective avec un antigène.
La mémoire immunitaire : analyse d'expérience
À partir de l’analyse d’expériences simples, réalisées chez les mammifères, on peut mettre en évidence l’existence d’une mémoire du système immunitaire mais aussi de certaines caractéristiques de cette mémoire.
I. Greffes de peau sur des souris
On travaille sur trois lignées de souris : des souris blanches (lignée A), des souris grises (lignée B) et des souris beiges (lignée C). Chaque ligne possède son propre génotype et elles ne sont pas compatibles en termes de greffe. Cela signifie que pour la receveuse greffée de la peau grise ou de la peau beige, la peau est reconnue comme un greffon du non-soi et il est donc rejeté par le système.
En effet, chez les souris comme chez les hommes, le système immunitaire reconnaît ce qui ne fait pas partie de l’organisme et est capable, par des réactions immunitaires complexes, de le rejeter, de se défendre contre ce non-soi.
Trois greffes successives sont réalisées vers des souris de type A :
– Dans la première greffe, on prend de la peau grise de souris B et on la greffe à une souris blanche : on observe un rejet du greffon au bout de 10 jours environ. Ce rejet est la marque de l’efficacité du système immunitaire qui repousse, qui rejette le non-soi.
– Dans la deuxième greffe, avec les mêmes souris qui ont reçu la première greffe : on leur greffe à nouveau de la peau de souris grise et on observe à nouveau un rejet mais cette fois-ci, le rejet est observé plus rapidement, au bout de trois jours seulement. Cela met en évidence que la souris qui avait déjà reçu la greffe de peau grise a gardé en mémoire la réaction qu’elle avait réalisé la première fois et, lors de la deuxième greffe, le système immunitaire a été plus efficace pour rejeter le même type de greffe.
– Dans la troisième greffe, on fait subir à ces mêmes souris un autre type de greffe : on greffe de la peau beige issue de la souris C, le rejet n’est pas très efficace car il a lieu seulement au bout de dix jours.
Ces trois greffes comparées permettent de dire qu’il existe une mémoire immunitaire. Autrement dit, la deuxième fois, le système immunitaire est plus efficace et plus rapide.
Avec cette expérience, on peut dire également que le système immunitaire a une mémoire immunitaire spécifique. En effet, lorsqu’on greffe un nouveau type de peau, le rejet est plutôt lent. Il existe donc une mémoire immunitaire chez les souris et cette mémoire est spécifique à un antigène donné.
II. Quantité de lymphocytes B produits au cours du temps chez des souris
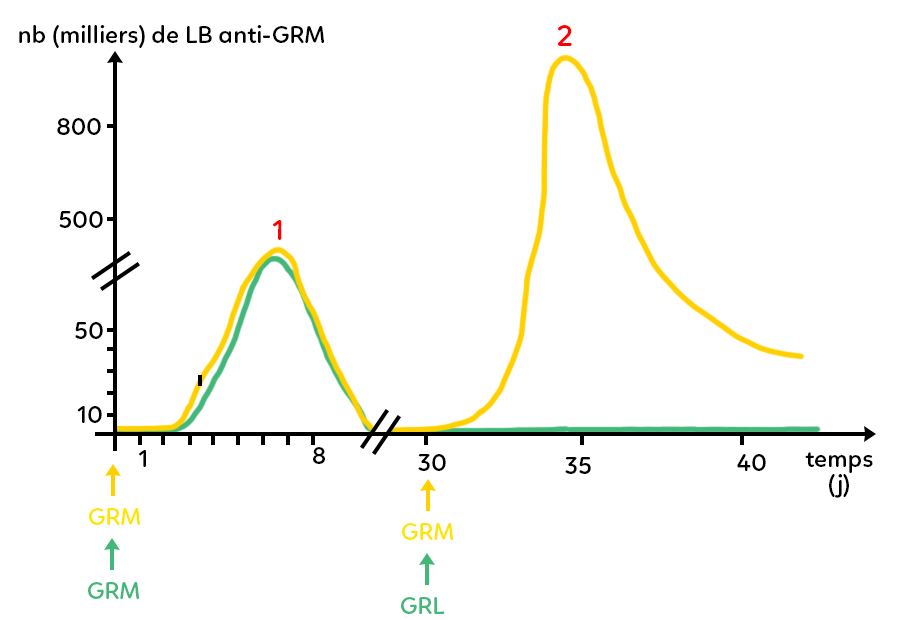
Toujours chez des souris, on suit la quantité de lymphocytes B produits au cours du temps. Ce sont des lymphocytes B anti-GRM. Les GRM sont des globules rouges de mouton, qu’on peut injecter à des souris et qui vont être reconnus comme du non-soi, comme la peau. En circulant dans le sang, ces globules rouges vont déclencher des réactions immunitaires, notamment la production de lymphocytes B donc de plasmocytes et d’anticorps anti-GRM suite à l’injection. Les globules rouges de mouton sont donc injectés dans le but de provoquer une réaction immunitaire.
On suit le nombre (en milliers) de lymphocytes B anti-GRM au cours du temps. On fait cela chez plusieurs types de souris.
Dans un premier temps, on injecte des globules rouges de mouton à un lot de souris et on observe qu’au bout de quelques jours elles se mettent à produire des lymphocytes B anti-GRM. Le taux maximal atteint est de l’ordre de quelques dizaines de milliers de lymphocytes B anti-GRM et ce maximum est atteint au bout d’une petite semaine en général 6 à 7 jours.
Suite à cela, le taux de lymphocytes B anti-GRM diminue et revient proche de zéro.
Ensuite, à ce même lot de souris (dont on a représenté l’évolution du taux de lymphocytes B en jaune), on attend que le taux revienne vers zéro et on injecte, au jour 30, une deuxième fois des GRM. On observe alors un deuxième type de réaction : à nouveau, le système immunitaire permet la production de lymphocytes B anti-GRM, mais comme dans le cas des greffes, on observe d’abord que cette production est beaucoup plus rapide à se mettre en place. On atteint un maximum au bout de 4 à 5 jours seulement et non pas 6 à 7 jours comme tout à l’heure. D’autre part, on voit que le maximum atteint est bien plus important en nombre de lymphocytes B que lors de la première injection : on atteint plus de 800 000 lymphocytes B anti-GRM en environ 4 jours.
Autrement dit, si on observe les deux courbes jaunes, on a d’abord une réaction immunitaire primaire : c’est la réaction qui fait suite au premier contact avec l’antigène (une réaction qui prend une petite semaine et qui permet de produire un certain nombre de lymphocytes B). Lors de la deuxième rencontre des mêmes souris avec le même antigène, on a une réaction immunitaire secondaire qui est plus rapide (moins deux jours pour être déclenchée) et plus efficace : il y a plus de lymphocytes B anti-GRM produits. Entre la réaction immunitaire primaire et la réaction immunitaire secondaire, le taux de lymphocytes B anti-GRM était bien revenu proche de zéro.
III. Expérience complémentaire
On fait subir la même injection à un autre lot de souris. On injecte des globules rouges du mouton. On observe une courbe superposée à la courbe jaune (il y a production en une petite semaine de quelques dizaines de milliers lymphocytes B).
Cependant, quand le taux de lymphocytes B est proche de zéro, on leur injecte des globules rouges de lapin et on observe que le taux de lymphocytes B anti-GRM reste proche de zéro : il n’y a pas de production de lymphocytes B anti-GRM. Il n’y a donc pas de réaction secondaire.
En revanche, si au cours d’une analyse de prise de sang, on regarde combien il y a de lymphocytes B anti-GRL, on peut quantifier ces lymphocytes B et on observe une courbe qui ressemblerait aux réactions immunitaires primaires, à savoir une augmentation lente du taux de lymphocytes B anti-GRL (qui prendrait 7 à 8 jours pour arriver à son paroxysme) et une quantité de lymphocytes B anti-GRL qui resterait de l’ordre de quelques dizaines de milliers. On a donc une réaction de type primaire contre les globules rouges de lapin. Cette dernière expérience permet à nouveau de mettre en évidence la spécificité de la mémoire.
Résumé
Les mammifères, et en particulier l’espèce humaine, possèdent une mémoire immunitaire. Notre système immunitaire garde une trace des infections, des antigènes qu’il a déjà rencontrés. Cette mémoire immunitaire permet à notre système d’être à la fois plus efficace et plus rapide dans sa défense lors d’une deuxième ou d’une troisième rencontre avec un même antigène. Néanmoins, cette mémoire immunitaire est spécifique : elle s’applique à un antigène donné et ne s’applique pas à tous les autres.
Les lymphocytes responsables de la mémoire immunitaire
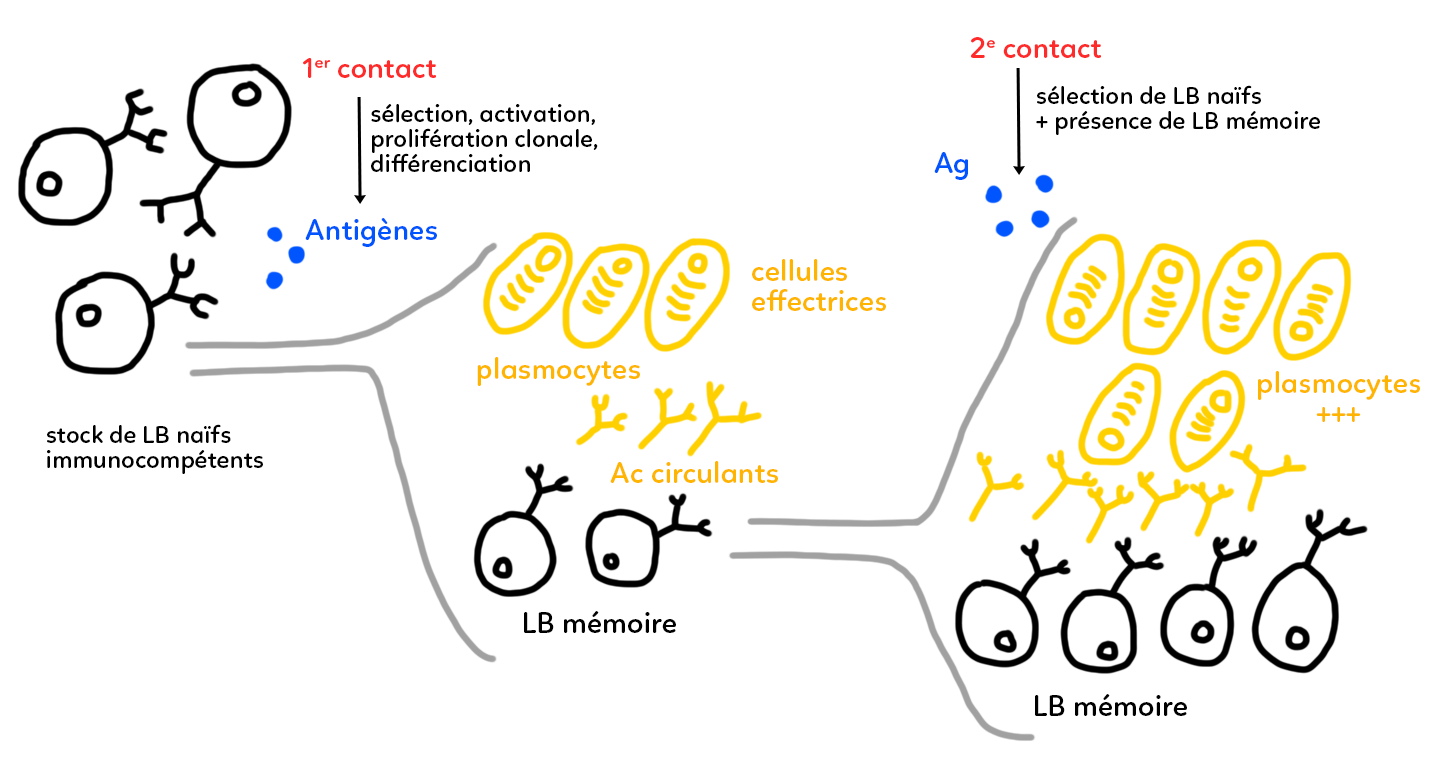
À partir d’un schéma, on va illustrer le principe du fonctionnement de la mémoire immunitaire. Pour cela on travaille sur les lymphocytes B, qui peuvent se différencier en plasmocytes, et qui sont des producteurs d’anticorps permettant de défendre l’organisme contre des antigènes ou des molécules antigéniques qui circulent dans le milieu extérieur, c’est-à-dire le sang.
Par des mécanismes génétiques complexes, le corps produit un stock de lymphocytes B qu’on appelle naïfs (tant qu’ils n’ont pas rencontré d’antigène) et qui sont immunocompétents, c’est-à-dire dirigés contre des molécules du non-soi. Ils ne reconnaissent pas les molécules du soi. Si c’était le cas, ils ont été éliminés au cours de la maturation au niveau de la moelle osseuse.
Premier contact
Lors du premier contact avec un antigène (en bleu sur le schéma) qui pénètre par exemple dans notre circulation sanguine, il y a sélection dans le stock, d’un ensemble de lymphocytes B qui possèdent à leur surface un anticorps membranaire adapté à la reconnaissance de l’antigène. Cette adaptation repose principalement sur une reconnaissance, c’est-à-dire une complémentarité tridimensionnelle entre la forme de l’antigène (le non-soi) et la forme des parties variables de l’anticorps qui représente le soi. Il y a une reconnaissance spécifique anticorps/antigène. Sur le schéma, on a représenté des antigènes sous forme sphérique qui vont s’adapter à un anticorps de surface (celui du bas) mais pas aux deux autres dessinés.
À la suite de ce premier contact, il y a donc une sélection. On sait que cette sélection aboutit sur une activation du pool de lymphocytes B. Cette activation débouche sur une prolifération clonale (ensemble répété de mitoses successives) et possède une division cellulaire très active qui permet d’obtenir un très grand nombre de lymphocytes B tous identiques : tous porteurs du même anticorps de surface, celui qui est adapté à l’antigène.
Cette étape de prolifération clonale débouche ensuite sur une étape de différenciation. Au cours de cette différenciation, une grande partie des lymphocytes B produits va se différencier en plasmocytes (en jaune). Ces plasmocytes (ou cellules effectrices) sont des producteurs d’anticorps circulants : ce sont des cellules qui ont toute une machinerie cellulaire spécialisée dans la production de protéines. Tous ces anticorps circulants sont rigoureusement identiques et adaptés dans leur forme à l’antigène qui a infecté l’organisme. On est dans une réaction immunitaire à médiation humorale. Dans le sang, il y a donc circulation de nombreux anticorps qui permettent de s’attaquer à l’antigène, de créer des complexes immuns qui seront ensuite phagocytés et détruits.
Cependant, une partie des lymphocytes B ne va pas se différencier en cellules effectrices mais en lymphocytes B mémoires. Ces lymphocytes B mémoires ne sont pas producteurs d’anticorps circulants mais ont la particularité d’avoir une durée de vie très longue (capables de vivre plusieurs années). Ils ont aussi des mécanismes de prolifération cellulaire lente, ce qui permet de compenser la mort de certaines cellules par la formation d’autres cellules. Ces lymphocytes B mémoires sont identiques et porteurs en surface de l’anticorps qui nous intéresse dans la réaction immunitaire que nous sommes en train de décrire. Ils permettent à l’organisme de stocker une mémoire de l’infection par l’antigène. Si les plasmocytes sont efficaces, la totalité de l’antigène est détruit dans les quelques jours, semaines ou mois suivants l’infection.
Deuxième contact
S’il y a un deuxième contact de l’organisme avec le même antigène (même plusieurs semaines, mois, voire années après), il va y avoir cette fois-ci sélection, peut être de lymphocytes B naïfs à nouveau, mais également, il va y avoir une aide par la présence des lymphocytes B mémoires conservés depuis le premier contact avec l’antigène.
Ces lymphocytes B mémoires vont donc à nouveau proliférer (par prolifération clonale) et donner une nouvelle série de plasmocytes identiques à ceux de la première réaction immunitaire. Lors de cette réaction immunitaire secondaire, les plasmocytes sont plus nombreux que la première fois. Puisqu’ils sont plus nombreux, ils sont également produits plus rapidement. On produit une plus grande quantité d’anticorps circulants, ce qui signifie que l’organisme est plus efficace dans sa défense contre l’antigène lors de la réaction secondaire.
Cette mémoire immunitaire permet donc de répondre plus vite et plus efficacement, c’est-à-dire de produire plus de molécules de défense. Parmi les lymphocytes B produits au cours de cette réaction secondaire, on a donc à nouveau des cellules effectrices, mais encore un petit pool de lymphocytes qui redonne des lymphocytes B mémoires. Ainsi, ces lymphocytes B mémoires vont, à nouveau, grâce à leur durée de vie longue, pouvoir être utilisés lors d’une réaction éventuellement tertiaire au cours de laquelle le même antigène se présenterait dans l’organisme.
Résumé
La présence de lymphocytes mémoires permet de garder, à long terme, un enregistrement des antigènes que l’organisme a déjà rencontré. Ces cellules mémoires, grâce à leur durée de vie très longue, permettent à l’organisme de se défendre plus efficacement lors d’une deuxième ou d’une troisième rencontre avec un même antigène. Cette mémoire est spécifique, c’est-à-dire qu’elle est dirigée contre un type d’antigène et pas un autre. Enfin, cette mémoire, c’est ce que l’on va exploiter au niveau médical lorsque l’on va se vacciner : on va stimuler la mémoire immunitaire.