Fonctionnement d'une pile
Fonctionnement d’une pile
Une pile est un objet qui convertit l’énergie chimique en énergie électrique avec quelques pertes sous forme d’énergie thermique. Précisons qu’une pile et un accumulateur ont le même fonctionnement, la seule différence c’est qu’un accumulateur peut être rechargé alors qu’une pile, par définition, ne peut pas être rechargée.
I. Constitution d’une pile
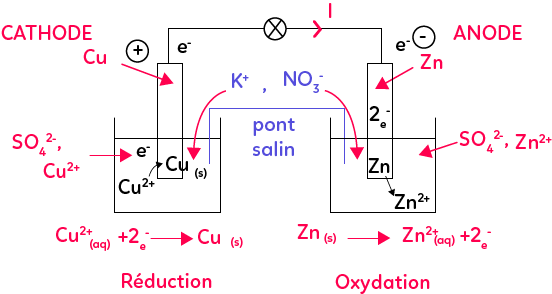
Une pile est constituée de deux demi-piles (gauche et droite) reliée par un pont salin. La pile que l’on étudie ici est la pile Daniell. Chaque demi-pile est constituée par une électrode qui est le plus souvent un métal et qui plonge dans une solution conduisant l’électricité donc une solution qui contient des ions.
La première demi-pile est constituée d’une lame de Cuivre plongée dans une solution de sulfate de Cuivre composée d’ions sulfate SO42- et des ions Cuivre Cu2+.
La deuxième demi-pile est constituée d’une lame de Zinc qui trempe dans une solution contenant du sulfate de Zinc (SO42- et Zn2+).
II. Fonctionnement d’une pile
On fournit ici les deux demi-équations d’oxydo-réduction qui permettent d’expliquer le fonctionnement de cette pile puisque c’est effectivement une réaction d’oxydo-réduction qui est à l’origine du fonctionnement de la pile.
Le métal Zinc va se transformer en Zn2+ en « éjectant » deux électrons. Les deux électrons vont partir de l’électrode de Zinc, vont arriver au niveau du circuit par le fil conducteur et vont traverser le récepteur branché aux bornes de la pile pour arriver ensuite de l’autre côté. En arrivant de l’autre côté, les électrons vont être captés par le Cu2+ en solution pour former du Cuivre solide grâce aux électrons. C’est cet échange d’électrons dans les réactions d’oxydo-réduction qui est à l’origine du courant électrique puisque, les électrons, en passant d’une demi-pile à une autre, vont donc produire ce courant électrique qui va faire fonctionner le récepteur, comme la lampe.
III. Bornes d’une pile
Voyons maintenant comment trouver les bornes de la pile. Si les électrons partent de l’électrode de Zinc pour aller vers celle de Cuivre, alors le Zinc sera la borne « – » (deux charges « – » se repoussent) et le Cuivre la borne « + » (les électrons chargés négativement vont être attirés par la borne « + »).
Par définition, l’électrode où se passe l’oxydation est appelée anode et celle où il y a une réduction est appelée cathode (moyen mnémotechnique : anode et oxydation = voyelles ; cathode et réduction = consonnes).
La demi-équation du Zinc est celle qui correspond à une oxydation puisqu’on forme ici l’oxydant. L’électrode de Zinc est alors l’anode. La demi-équation du Cuivre est celle qui correspond à une réduction puisqu’on forme le réducteur du couple. Cette électrode sera appelée la cathode. Dans le cas d’une pile, l’anode est toujours négative et la cathode est positive mais ça n’est pas toujours le cas donc il faut toujours bien le démontrer.
IV. Sens conventionnel du courant électrique
Une fois que l’on a le sens de déplacement des électrons qui est indiqué, on peut avoir le sens conventionnel du courant électrique. Le sens du courant électrique c’est l’opposé de celui des électrons. Il est orienté dans le sens inverse ce qui est logique puisqu’on sait que le courant électrique va de la borne « + » de la pile vers la borne « – » de la pile, en passant par l’extérieur du circuit.
V. Importance du pont salin
Il ne faut pas oublier le pont salin dans les expériences. Généralement, en TP, si la pile de fonctionne pas, c’est que le pont salin a été oublié. Le pont salin est un papier filtre ou du gel qui contient des ions à l’intérieur. Il permet de faire la jonction au niveau des solutions de la pile et il assure l’électroneutralité de la pile. En effet avec la réaction du Zinc, on produit des ions Zn2+, on a donc des charges positives qui arrivent dans la solution.
Une solution ne peut pas être chargée positivement, elle est toujours neutre. On a les ions NO3- qui vont venir dans la solution de sulfate de Zinc pour compenser les charges positives qui apparaissent. A l’inverse, de l’autre côté, on va consommer des charges positives, on va avoir plus de SO42- que de Cu2+. Pour compenser cette charge positive qui disparaît de la solution, on va avoir des ions K+ du pont salin qui vont arriver dans la solution de sulfate de Cuivre.
VI. Quand la pile arrête-t-elle de débiter ?
Elle s’arrête de débiter lorsqu’il n’y a plus d’électrode de Zinc, ce qui n’est pas souvent le cas, ou lorsqu’il n’y a plus de Cu2+. C’est souvent le Cu2+ qui limite le fonctionnement de la pile. On va donc écrire l’équation d’oxydo-réduction qui régit le fonctionnement de cette pile. Il suffit d’additionner ces deux demi-équations d’oxydo-réduction.
La pile à combustible
La pile à combustible
I. Fonctionnement de la pile
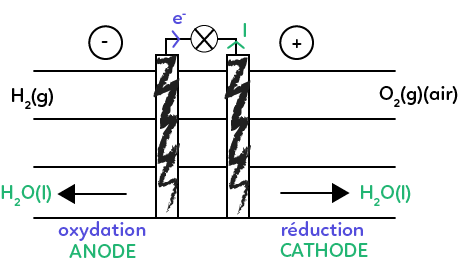
Voici le schéma de fonctionnement d’une pile à combustible. Les deux couples oxydant/réducteur qui sont mis en jeu dans le fonctionnement de cette pile sont les suivants : $H^+_{(aq)}$ / $H_{2(g)}$ et $O_{2(g)}$ / $H_2O_{(l)}.$
On demande quelle est l’équation de la réaction d’oxydo-réduction, support du fonctionnement de cette pile. Pour savoir quelle est cette équation d’oxydo-réduction, on analyse le fonctionnement de la pile. Il est indiqué que le borne « + » est à droite. Le sens conventionnel du courant est du « + » vers le « – ». Les électrons vont du « – » vers le « + » donc ils partent de l’électrode négative pour aller vers l’électrode positive.
Sur cette électrode, on a des électrons qui sont éjectés, donc on a une oxydation sur l’électrode négative. Sur l’électrode positive, on capte les électrons pour avoir la réaction, on fait une réduction. L’électrode où il y a l’oxydation s’appelle l’anode. L’électrode où se passe la réduction s’appelle la cathode. On sait maintenant où se passe la réduction et où se passe l’oxydation.
II. Équation de la réaction d’oxydo-réduction
On écrit les demi-équations d’oxydo-réduction dans le sens de l’oxydation pour l’anode et dans le sens de la réduction pour la cathode.
À l’anode on a la demi-équation suivante :
$2H^+_{(aq)} + 2e^- \rightarrow H_{2(g)}$
$H_{2(g)} \rightarrow 2H^+_{(aq)} + 2e^-$
On doit avoir deux hydrogènes de chaque côté et on a libération de deux électrons puisque l’on a deux ions $H^+$ avec deux charges positives.
On s’intéresse à ce qui se passe du côté de la réduction, à la cathode. Voici la demi-équation correspondante :
$4e^- + O_{2(g)} + 4H^+_{(aq)} → 2H_2O_{(l)}$
On doit équilibrer la demi-équation. Pour cela on ajoute « $2$ » devant l’eau pour avoir le même nombre d’oxygène de chaque côté. On a donc quatre $H$ à droite mais pas de $H$ à gauche donc on rajoute quatre $H^+$ à gauche. Pour compenser les quatre charges positives des ions $H^+$ à gauche, on rajoute à gauche quatre électrons. Le réducteur (l’eau) est bien à droite de la demi-équation donc on a bien une réduction.
Pour avoir l’équation de la réaction d’oxydo-réduction qui est à l’origine du fonctionnement de la pile, il faut additionner ces deux demi-équations d’oxydo-réduction. On multiplie la demi-équation d’oxydo-réduction avec $ H_2$ et $H^+$ pour avoir le même nombre d’électrons dans chaque demi-équation $2H_{2(g)} \rightarrow 4H^+_{(aq)} + 4e^-.$
On peut simplifier les électrons. On peut simplifier également les $4H^+$.
Donc, l’équation d’oxydo-réduction est la suivante :
$O_{2(g)} + 2H_{2(g)} \rightarrow 2H_2O_{(l)}$
L’avantage de cette pile à combustible est que les réactifs sont le dioxygène (que l’on peut récupérer dans l’air) et de l’autre côté le dihydrogène et que cette pile va seulement rejeter de l’eau. Si on utilise cette pile, on peut avoir de l’électricité à partir de ces deux gaz en ne rejetant que de l’eau.