Le modèle de l'atome
Le modèle de l’atome
I. Modèle
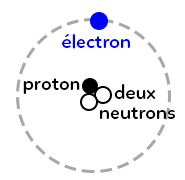
Un atome est une entité neutre (ce n’est pas un ion !).
Un atome est composé d’un noyau, qui lui même est composé de neutrons et de protons ainsi que d’électrons qui gravitent autour du noyau.
On appelle aussi les neutrons et les protons des nucléons.
Charges
Les électrons sont chargés négativement, les protons sont chargés positivement.
Les neutrons n’ont pas de charges.
Comme un atome est une entité neutre, cela veut dire qu’il y a toujours le même nombre de protons et d’électrons pour un atome.
Masse
On considère que la masse de l’atome est environ la même que la masse du noyau de l’atome. En effet, les électrons sont extrêmement légers par rapport aux nucléons.
Une formule assez naïve est : $m_{noyau}=A \times m_{nucléon}$, où $A$ est le nombre de nucléons dans le noyau.
II. Notation
Il y a une notation spécifique aux atomes qu’il faut connaître. On les note : $^{A}_{Z}X$, où $X$ est le symbole de l’élément, $A$ est le nombre de nucléons et $Z$ est le nombre de protons appelé le numéro atomique.
Pour trouver le nombre de neutrons la formule est donc : $N=A-Z$.
Exemple : l’hydrogène se note : $^{1}_{1}H.$ Celui-ci possède donc 1 nucléon (A=1) et 1 proton (Z=1), donc il ne possède pas de neutrons.
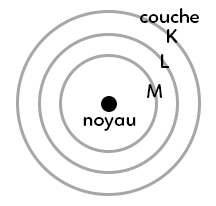
III. Répartition des électrons en couche
Les électrons se répartissent sous forme de couches autour du noyau :
La première couche est la couche (K), la deuxième (L) et la troisième (M). Les électrons vont se répartir selon leur nombre sur les différentes couches en commençant par la couche intérieure (K). Néanmoins, chaque couche possède un nombre maximal d’électrons qu’elle peut contenir :
K : 2 électrons maximum
L : 8 électrons maximum
M : 18 électrons maximum
On remplit ensuite d’abord K, puis L, puis M.
Exemple : l’atome de carbone se note $^{12}_{6}C.$ Il y a donc 6 protons dans le noyau, ce qui veut dire qu’il y a 6 électrons à placer sur les couches. En effet, l’atome doit rester neutre. La répartition est donc $(K)^2 (L)^4.$
L'élément chimique
I. Définition
Un élément chimique est définit par son numéro atomique Z (voir cours sur le modèle de l’atome). On utilise un symbole pour le représenter.
Exemple : Z=26 est l’atome $Fe,$ qui peut se décliner : il y a l’atome Fe, mais aussi les ions fer $Fe^{2+}$ et $Fe^{3+}$.
II. Les isotopes
Il existe des isotopes de certains éléments chimiques. Les isotopes sont deux atomes qui ont le même nombre de protons mais un nombre de neutrons différents.
Exemple :
Il y a le carbone $12 ^{12}_6C.$
Et le carbone 14, $14 ^{12}_6C$ (utilisé dans la datation au carbone 14).
III. Les ions monoatomiques
Certains éléments chimiques peuvent être sous forme d’ions monoatomiques.
Le cation
Un cation est un atome qui a perdu au moins un électrons de sa couche externe, il est chargé positivement.
Exemple : $Na^+ $ ou $Mg^{2+}$
L’anion
Un anion est un atome qui a gagné au moins un électrons de sa couche externe, il est chargé négativement.
Exemple : $Cl^- $ ou $HO^{-}$
Configuration électronique
I. Le cortège électronique
Il faut comprendre comment se répartissent les électrons d’un atome autour du noyau et comment établir la configuration électronique d’un atome. Tout d’abord le cortège électronique se répartit sur plusieurs couches qui sont séparées en plusieurs sous-couches.
Les couches sont repérées par des nombre : 1, 2 ou 3.
Les sous-couches sont repérées par des lettres : s ou p.
Il y a un ordre d’énergie croissant pour les sous-couches : 1s, 2s, 2p, 3s, 3p.
Les électrons s vont donc se répartir sur les sous-couches en partant de la plus basse en énergie. On peut remplir une sous-couche que par un certain nombre d’électrons :
– les sous-couches s (1s, 2s et 3s) ne peuvent accueillir que 2 électrons,
– les sous-couches p (2p et 3p) ne peuvent accueillir que 6 électrons.
II. Exemples de configuration électronique
L’atome d’hydrogène H
Avec Z=1, cet atome ne possède qu’un seul électron. Sa configuration électronique est donc $1s^1$ : il n’y a qu’un électron sur la sous-couche la plus basse en énergie qui est 1s.
L’atome de carbone C
Avec Z=6, cet atome possède 6 électrons. Sa configuration électronique est donc $1s^2 2s^2 2p^2$.
Dans le tableau périodique des éléments la configuration électronique évolue selon les lignes et les colonnes :
– Dans une même ligne, on remplit une couche entièrement : par exemple dans la première ligne du tableau périodique on a H = $1s^1$ et He = $1s^2$, et dans la deuxième ligne on remplit la couche $2$ ( C = $1s^2 2s^2 2p^2$ et Ne = $1s^2 2s^2 2p^6$).
– Dans une même colonne, on a le même nombre d’électrons de valence pour tous les atomes. Les électrons de valence sont les électrons qui sont présents sur la dernière couche. Par exemple, le carbone possède 4 électrons de valence, de même que le silicium Si = $1s^2 2s^2 2p^6 3s^2 3p^2$.