Les enzymes : des biocatalyseurs
Expérimentalement, on va chercher à remettre en évidence la nature et le rôle des enzymes, molécules produites par les êtres vivants.
Exemple de l’hydrolyse progressive de l’amidon
L’amidon est une molécule qui se trouve notamment dans l’alimentation (pâtes, pommes de terre, riz, pain). C’est une molécule que l’on est amené à digérer, c’est-à-dire à découper en petites molécules.
On part d’un tube à essai dans lequel on a mis de l’empois d’amidon (poudre pure d’amidon avec de l’eau).
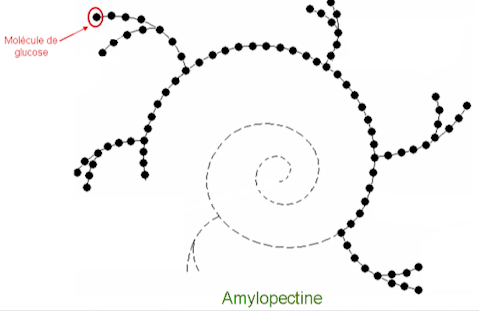
On dit que la molécule d’amidon (ci-dessus) est une macromolécule car il s’agit d’un assemblage de très nombreuses molécules de glucose (beaucoup plus petites). Il y a des chaînes ramifiées de glucose, qui, mises bout à bout, composent l’amidon.
On fait agir différents réactifs sur le tube contenant l’empois d’amidon.
I. Réaction avec l’acide chlorhydrique
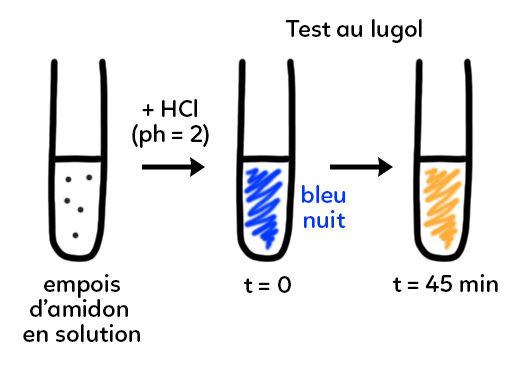
Dans un premier temps, on fait réagir de l’acide chlorhydrique HCl (pH = 2) avec la solution d’empois d’amidon. On va ensuite réaliser un test au lugol (ou eau iodée). Il permet de mettre en évidence, selon sa coloration, la présence ou l’absence d’amidon. Lorsque le lugol, jaune-orangé, prend une coloration bleu nuit : il y a présence d’amidon. A t = 0, si on ajoute du lugol à l’empois d’amidon, on obtient une coloration bleu nuit qui montre que la solution est riche en amidon.
Si on laisse agir l’HCl, au bout de 45 min environ selon la concentration en acide, on obtient une coloration qui va virer au jaune-orangé. Le lugol ne réagit plus avec l’amidon car il n’y a plus d’amidon dans la solution. On retrouve la coloration initiale du lugol. Il y a eu disparition, digestion, de l’amidon qui a été transformé en plusieurs dizaines de minutes en présence d’acide chlorhydrique.
Qu’est devenu cet amidon transformé ?
On peut réaliser un autre test avec un autre marqueur : la liqueur de Fehling. Elle permet de mettre en évidence des sucres réducteurs (des petites molécules glucidiques comme le glucose). Lorsque elle est en présence de sucres réducteurs, elle passe d’une couleur bleue à une couleur rouge. Si on fait un test à la liqueur de Fehling à t = 0, au début de la digestion par HCl, il n’y a pas de sucres réducteurs. Au bout des 45min, on observe un précipité rouge brique. On en conclut que l’amidon a été hydrolysé en présence d’acide (hydrolyse acide) sous forme de glucose. Il y a effectivement présence de sucres réducteurs et, par des tests plus poussés, on peut dire qu’il s’agit du glucose.
II. Réaction avec l’amylase salivaire
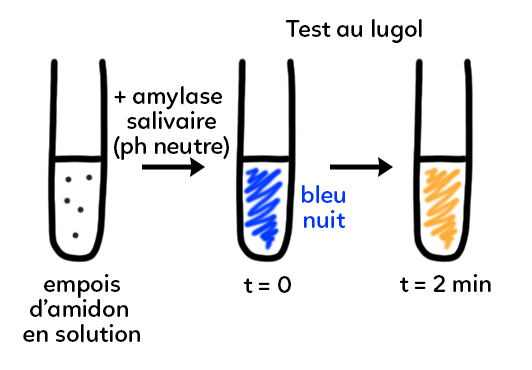
Dans un deuxième temps, on va réaliser une hydrolyse de l’amidon par une enzyme (protéine produite par les êtres vivants). On reprend la solution d’empois d’amidon de départ et on la met en présence d’amylase salivaire (molécule présente dans notre salive). On observe la même disparition de l’amidon par rapport à la première expérience sauf que :
– On se trouve à pH neutre.
– L’amylase peut agir à température corporelle : 37°C.
– La réaction dure 2 min.
On a donc une disparition de l’amidon très rapide, à pH et température compatibles avec la vie.
Si on réalise le test à la liqueur de Fehling, au bout de 2 min, on est en présence de sucres réducteurs. Il y a bien eu une séparation des molécules constituants l’amidon, une hydrolyse et transformation en sucres réducteurs. Dans un autre test, on peut voir qu’il ne s’agit pas de glucose mais de maltose.
Le maltose est l’assemblage de deux molécules de glucose. Dans la digestion, l’amidon sera d’abord réduit en maltose puis le maltose en glucose, grâce à d’autres enzymes.
Au bilan, on a montré que les enzymes étaient des biocatalyseurs : des catalyseurs de réactions chimiques dans des conditions compatibles avec la vie.
III. Test du Biuret
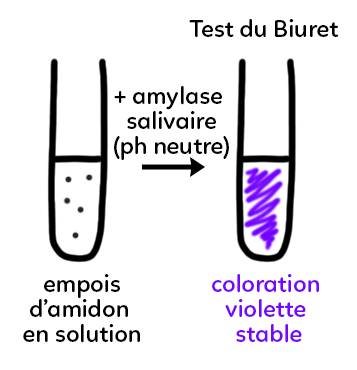
Si on prend le tube de départ et qu’on y ajoute l’amylase salivaire et qu’on réalise le test du Biuret, on obtient une coloration violette stable qui signifie que l’on est en présence d’une molécule de nature protéique. Cette coloration persiste.
Cela permet de dire que les biocatalyseurs sont des protéines produites par l’organisme et qui vont permettre de faciliter certaines réactions chimiques.
Si on test l’effet de l’amylase salivaire sur un autre substrat (on remplace l’empois d’amidon par de la cellulose), les résultats seront négatifs : il n’y a pas d’hydrolyse de la cellulose par l’amylase. Cela permet de mettre en évidence la spécificité du substrat d’une enzyme. Une enzyme va pouvoir agir sur un substrat, une cible, et par un autre.
Mode d'action de la catalyse enzymatique
Une enzyme est une protéine qui joue le rôle de biocatalyseur, in vivo elle va catalyser, faciliter des réactions biochimiques. Pour cela, elle va agir sur une molécule en particulier : son substrat.
Comment se déroule la catalyse enzymatique ?
Ce mode d’action a été étudié par deux scientifiques : Michaelis et Menten, au début du XXe siècle. Mais, auparavant, un autre scientifique nommé Fisher avait déjà une intuition sur une complémentarité des formes de l’enzyme et de son substrat et donc un attachement possible (une fixation transitoire) qui aurait rendu possible cette catalyse enzymatique.
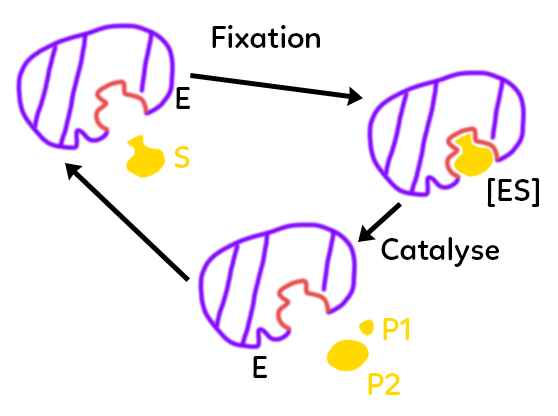
Une enzyme est une protéine donc elle est produite par l’expression d’un ou plusieurs gènes. C’est une suite d’acides aminés attachés les uns aux autres par des liaisons peptidiques. Comme toutes les protéines, grâce à ses acides aminés, l’enzyme va avoir de façon native une configuration tridimensionnelle particulière. On a donc une forme particulière que prennent les acides aminés de façon naturelle au moment de la production de l’enzyme. Cette forme spécifique va délimiter ce qu’on appelle un site actif pour l’enzyme. C’est un ensemble de quelques acides aminés, en général une dizaine voire parfois une centaine, qui va comprendre un site de liaison au substrat et également un site catalytique (par exemple : couper un substrat en deux ou en attacher deux ensemble pour en faire un autre particulier). Cette enzyme, grâce à son site actif, va se lier à son substrat. On va pouvoir décrire comme un cycle de catalyse, représenté ici.
L’enzyme (violet) au départ présente un site actif (rouge) qui comprend à la fois le site de liaison et le site catalytique. Le substrat (jaune) va pouvoir, grâce à sa forme, être adapté à la forme du site actif. Ils vont donc se lier et former un complexe enzyme-substrat [ES].
Au départ pour Fisher, le modèle était plutôt rigide et le substrat s’adaptait à l’enzyme comme une clé dans une serrure. En réalité, actuellement, on pense plutôt qu’il y a une adaptation, un ajustement induit.
Les formes de l’enzyme et du substrat sont complémentaires mais peuvent être légèrement modifiées au moment où le complexe se forme. Lorsque le complexe enzyme-substrat est formé, le rôle catalytique de l’enzyme va pouvoir se jouer : les acides aminés partie catalytique du site vont faciliter la découpe en deux du substrat. On va avoir la catalyse et la division du substrat en deux produits P1 et P2. Ces deux produits quittent ensuite le site actif qui est libéré et l’enzyme est récupérée telle quelle dans sa forme initiale. On retourne donc à l’état initial avec possibilité pour l’enzyme de servir à nouveau.
On obtient cette réaction : E+S -> [ES] -> E+P
La présence du site actif avec sa forme particulière due à la composition en acides aminés est responsable de deux caractéristiques des enzymes :
– La spécificité du substrat : grâce à sa forme. Par exemple, on a vu que l’amylase de notre salive est une enzyme adaptée pour l’hydrolyse de l’amidon. Si on met cette enzyme en présence d’un autre glucide, la cellulose, dont la formule est proche mais pas tout à fait identique à celle de l’amidon alors l’amylase n’est pas efficace pour hydrolyser la cellulose.
– La spécificité d’action : grâce aux acides aminés de la partie catalytique. En effet, une enzyme va avoir qu’une action biochimique particulière. Par exemple, ici, elle coupe le substrat en deux produits. Il existe des enzymes qui ont d’autres modes d’action : attacher deux substrats en un seul produit.
Il y a donc une double spécificité des enzymes et cela est dû à la présence du site actif aménagé en fonction de sa composition en acides aminés dans la protéine. L’enzyme revient à son état initial et peut être réutilisée à l’infini. Néanmoins, l’enzyme comme toute protéine est dénaturable. Par exemple, sous une trop forte chaleur. Si on place de l’amylase à une plus grande température que celle du corps humain, l’enzyme va être dénaturée. C’est-à-dire que la structure tridimensionnelle totale de la protéine est désorganisée et on perd le site actif : l’enzyme ne peut plus agir.
Chaque enzyme a un pH optimal, si on modifie ce pH (par exemple : pH acide), la structure tridimensionnelle de l’enzyme sera perdue et le site actif n’existe plus : l’enzyme est dénaturée. Enfin, on comprend aussi qu’une mutation génétique qui modifierait la séquence d’acides aminés pourrait avoir des conséquence sur la forme de l’enzyme et rendre l’enzyme inutilisable, ce qui est parfois source de maladies génétiques.
L'équipement enzymatique particulier de chaque cellule
On appelle équipement enzymatique l’ensemble des enzymes présentes à un instant donné dans la vie d’une cellule. Elles vont permettre de réaliser un certain nombre de réactions biochimiques en les catalysant. L’équipement enzymatique peut varier au cours du temps mais il peut aussi surtout varier d’une cellule à une autre par exemple dans le corps humain. Il peut aussi varier d’un individu à un autre.
I. Génotype et équipement enzymatique
Le génotype est l’ensemble des allèles d’une cellule ou d’un individu. Les humains possèdent tous le même génome, constitué de 20 à 25 000 gènes, mais chaque humain possède des génotypes différents. Ces génotypes sont responsables de nos différences interindividuelles, et il en va des enzymes comme du reste des protéines. L’équipement enzymatique est dépendant, puisque les protéines sont codées par des gènes, du génotype de l’individu. Ainsi, selon l’allèle porté pour le gène codant une enzyme, un individu pourra avoir une enzyme différente d’un autre individu.
Parfois les allèles vont être différents mais les enzymes vont réaliser le même travail. En revanche parfois des enzymes différentes vont aboutir à des différences au niveau moléculaire ou au niveau cellulaire.
A. Diversité interindividuelle : cas des groupes sanguins
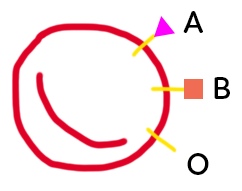
On a représenté ci-dessus de façon schématique, un globule rouge. Sur ce globule rouge, chaque individu va porter différents marqueurs qui constituent son groupe sanguin. Les marqueurs A, B et O diffèrent par la zone qui se trouve à l’extérieur du globule rouge. Ce marqueur est constitué d’un précurseur, représenté sous forme d’un bâtonnet, qui se trouve dans la membrane et qu’on appelle substance H. À ce précurseur est ajouté, ou non, un petit marqueur, représenté A ou B. L’ajout de ce marqueur sur la substance H dépend de l’équipement enzymatique de l’individu. L’enzyme qui réalise ce marquage est codée par un gène qui se trouve sur le chromosome 9, il en existe plusieurs versions. L’individu peut avoir l’enzyme A, ce qui donnera un groupe sanguin A, ou l’individu possédera l’enzyme B, on aboutira alors à des marqueurs B à la surface du globule rouge.
Il y a aussi une enzyme O, non fonctionnelle, qui n’aboutit à rien en terme d’ajout au niveau du marqueur H. On a donc des globules rouges qui possèdent le marqueur H à nu. Cela va donner le groupe O.
Des individus peuvent posséder l’enzyme A et l’enzyme B puisque certaines personnes sont de groupe sanguin AB.
La diversité des allèles permettant de coder ces enzymes aboutit à une diversité des groupes sanguins. Donc la diversité des génotypes aboutit à une diversité de l’équipement enzymatique.
B. Dysfonctionnements métaboliques : cas de l’albinisme
L’albinisme est un problème au niveau de la peau dû à une mauvaise, voire à une non synthèse de la mélanine. La mélanine est le pigment qui donne sa couleur à la peau. Chez les individus albinos, la peau est toute blanche, il peut aussi y avoir une rougeur au niveau des yeux et d’autres symptômes particuliers.
Dans le cas normal, au niveau des cellules de la peau qu’on appelle des mélanosomes, la tyrosine est transformée au cours de différentes étapes (grâce à différentes enzymes E1, E2, E3, etc.) en une molécule de mélanine. La première enzyme responsable de cette transformation est la tyrosinase. Chez les individus albinos la tyrosinase est dysfonctionnelle. De ce fait toute la suite de réactions se fait mal et il n’y a donc pas ou peu de mélanine. Selon la production ou non de cette enzyme, on va avoir des phénotypes c’est-à-dire des apparences différentes.
II. Spécialisation cellulaire et équipement enzymatique
– Il existe des enzymes ubiquitaires, c’est-à-dire qu’on trouve dans toutes les cellules ou presque de notre organisme. C’est le cas de l’ADN polymérase qui est l’enzyme impliquée dans la réplication de l’ADN à l’intérieur du noyau des cellules.
– Il existe des enzymes spécifiques, c’est-à-dire qu’on va trouver uniquement dans certains organes ou certains tissus et qu’on ne trouvera quasiment pas ailleurs. C’est le cas de l’amylase, impliquée dans la digestion de l’amidon, enzyme caractéristique du tube digestif, qu’on ne trouve pas dans les neurones ou dans les cellules musculaires. C’est le cas aussi de la tyrosinase, impliquée dans la synthèse de mélanine. Cette enzyme tyrosinase est produite dans les mélanosomes, dans les cellules de la peau, mais pas ailleurs.
– À un substrat peuvent correspondre différentes enzymes : un même substrat peut être transformé de différentes façons selon l’enzyme qui intervient et cela va dépendre de l’endroit, c’est-à-dire de l’organe ou du tissu dans lequel on se trouve dans le corps. Donc un substrat peut correspondre à différentes transformations, différentes catalyses, par différentes enzymes, selon les cellules.
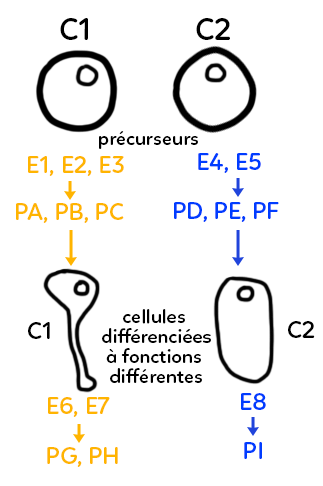
Dans l’exemple représenté ci-dessous, on part de deux cellules quasiment identiques, qu’on pourrait appeler cellules précurseurs, ce sont deux cellules non différenciées de notre organisme, par exemple au cours de la croissance d’un individu.
Ces cellules vont fabriquer différentes enzymes en fonction de l’endroit et des stimulations qu’elles subissent qui peuvent être extérieures ou intérieures.
Elles vont exploiter leur patrimoine génétique différemment et produire, par exemple à gauche, trois enzymes E1, E2 et E3 et deux enzymes dans la cellule de droite, E4 et E5. Ces enzymes vont permettre la production de différents produits notés PA, PB, PC à gauche, qui ne seront pas les mêmes à gauche et à droite puisqu’on n’a pas les mêmes enzymes. Ici, à droite on a représenté les produits PD, PE, PF. Ces produits, qui sont des molécules chimiques, vont pouvoir intervenir, mais de façon différente, dans l’évolution de la cellule et dans sa transformation progressive.
En partant de cellules précurseurs, on peut imaginer obtenir deux cellules différenciées (une cellule différenciée se caractérisant par une forme et un contenu spécifique, un contenu enzymatique et un contenu biochimique en général).
Sur le schéma, on a représenté en bas deux cellules de formes différentes (une cellule à forme allongée à gauche qui pourrait devenir par exemple un neurone, et une cellule de forme plus ovale qui pourrait devenir n’importe quelle autre cellule du corps). Dans cet exemple fictif, on aboutit, grâce à un équipement enzymatique différent, à deux types cellulaires différents. Ces cellules différenciées vont ensuite jouer des rôles différents au sein de l’organisme. On va dire que les fonctions cellulaires sont différentes. Ces fonctions cellulaires différentes passeront à nouveau par l’utilisation d’enzymes différentes. Grâce à l’utilisation d’enzymes différentes, on aboutit à des formes et des cellules différenciées distinctes et, ensuite au sein de ces cellules différenciées distinctes, on va exploiter à nouveau le génome, produire de nouvelles enzymes différentes des premières, mais aussi différentes à gauche et à droite. À gauche, on produit E6 et E7, à droite l’enzyme E8, et cela va donner à nouveau des produits biochimiques distincts, les produits PG et PH à gauche, le produit PI à droite.
Autrement dit, la différenciation cellulaire, qui permet au corps d’avoir différents tissus et différentes cellules différenciées dans différentes fonctions, repose sur une utilisation du patrimoine génétique qui permet entre autres de produire un panel d’enzymes très large et ensuite de jouer des rôles différents dans chacune de ces cellules. La différenciation et la spécialisation cellulaire reposent donc en partie sur l’équipement enzymatique.
Un exemple pour terminer : selon le type cellulaire, la tyrosine peut avoir différents devenir.
– Dans les mélanosomes, la tyrosine va être progressivement transformée en mélanine.
– Dans certains neurones, la tyrosine grâce à d’autres enzymes aura un devenir différent, elle sera transformée en un neurotransmetteur ou neuromédiateur qu’on appelle la noradrénaline. Cela se fera grâce à une autre enzyme, la tyrosine hydroxylase.
– Dans la thyroïde, une glande qui se trouve dans notre cou, la tyrosine se voit greffée de l’iode par une troisième enzyme qu’on appelle la thyropéroxydase et ensuite cette tyrosine iodée est stockée au sein de la thyroïde.
Avec la tyrosine, selon l’enzyme qu’elle rencontre, un même substrat peut avoir différents devenir. Tout cela est lié à la spécialisation cellulaire.
Étude de la cinétique de l'activité catalytique enzymatique
Étudier la cinétique des réactions chimiques ou biochimiques c’est s’intéresser à la vitesse de ces réactions. Cette vitesse peut varier au cours du temps en fonction des concentrations en substrat ou en produit. On s’intéresse à la cinétique de l’activité catalytique des enzymes : on étudie la vitesse à laquelle le substrat de l’enzyme peut disparaître ou bien la vitesse à laquelle le ou les produits peuvent être formés.
Nous allons travailler sur trois graphiques qui valident le modèle de Michaelis et Menten, qui ont compris, au début du XXe siècle, comment fonctionne une enzyme, à savoir que l’activité catalytique est basée sur une complémentarité tridimensionnelle entre l’enzyme et son substrat qui permet un attachement, la formation d’un complexe transitoire et alors la catalyse à proprement parler.
I. Quantité de produits formés en fonction du temps
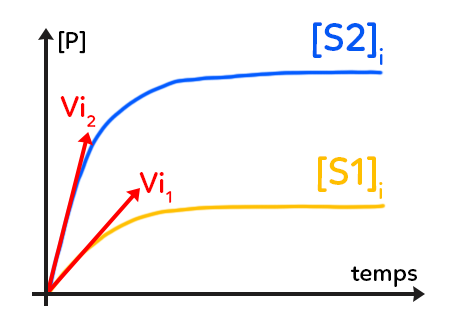
Ce graphique traduit la quantité de produit(s) (il peut y avoir un ou plusieurs produits formés au cours d’une catalyse enzymatique) formés en fonction du temps.
La concentration en produit(s) est en ordonnée (les concentrations sont toujours notées entre crochets, en fonction du temps). Dans les trois graphiques, les unités sont toujours arbitraires. Dans celui-ci, on se place à une concentration enzymatique constante, qu’elle soit libre ou que son site actif soit occupé. On étudie cette variation de la concentration de produits formés pour deux concentrations en substrat initiales notées S1 et S2.
Dans les deux cas, on voit une courbe qui a la même forme, avec au départ, une pente importante puis une pente qui diminue. La concentration S1 initiale (première concentration de substrat étudiée) est inférieure à la concentration de substrat S2. On constate logiquement, qu’on forme plus de produit(s) pour une concentration de substrat supérieure, donc dans le cas numéro 2.
On s’intéresse aux tangentes à la courbe, tracées en rouge. La tangente est une droite dont la pente va donner la vitesse de réaction. Pour calculer la pente (le coefficient directeur de ces tangentes), on a la variation de la concentration de produit(s) sur la variation du temps. Ainsi, le coefficient directeur des tangentes donne la vitesse de réaction, ici, de catalyse enzymatique à n’importe quel point de la courbe.
Remarques : il a été tracé en rouge les tangentes à l’origine, au début de la catalyse enzymatique. On parle de vitesse initiale et on observe que dans le premier cas, avec peu de substrat, cette vitesse initiale est inférieure à la vitesse initiale du deuxième cas, avec une concentration en substrat supérieure. La concentration en substrat influence la vitesse initiale de la catalyse enzymatique.
Par ailleurs, dans les deux cas, la vitesse atteinte au bout d’un certain temps est nulle puisque la tangente serait horizontale, donc de coefficient directeur nul. Dans les deux cas, la catalyse enzymatique arrive à sa fin. On peut supposer que le substrat a été entièrement consommé, c’est-à-dire entièrement transformé grâce à l’enzyme, et la concentration atteinte de produit est maximale, on obtient donc moins de produit dans le cas numéro 1, avec moins de substrat au départ, qu’on en obtient dans le cas numéro 2.
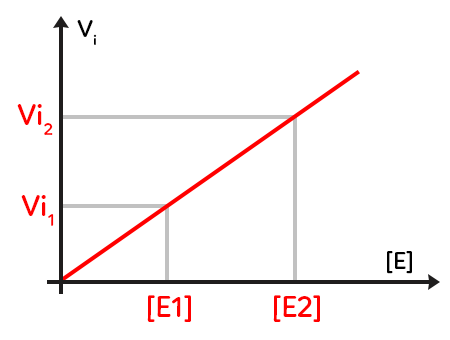
II. Vitesse initiale de la catalyse en fonction de la concentration enzymatique
Ce deuxième graphique traduit la vitesse initiale de la catalyse enzymatique en fonction de la concentration en enzyme.
La concentration en enzyme se trouve en abscisse, la vitesse initiale en ordonnée et on travaille à une concentration initiale en substrat constante, quel que soit le point qu’on étudie, on est parti de la même quantité de substrat. On constate que le tracé de cette courbe donne une droite qui passe par l’origine donc la vitesse initiale est proportionnelle à la concentration, c’est-à-dire la quantité d’enzymes disponibles pour catalyser la réaction que l’on étudie. En augmentant la quantité d’enzymes disponibles au départ, en passant par exemple de E1 à E2, on augmente la vitesse initiale de réaction.
On peut donc dire que la vitesse initiale est à la fois liée à la concentration initiale de substrat, mais aussi à la concentration d’enzymes disponibles. Cela vient corroborer de modèle de Michaelis-Menden qui dit qu’il y a une conformation permettant un assemblage spécifique entre l’enzyme et le substrat. Plus il y a de substrat, plus l’enzyme peut travailler. Plus il y a d’enzymes disponibles, plus il y a de molécules de substrat qui peuvent être transformées en même temps donc plus la catalyse globale sera rapide.
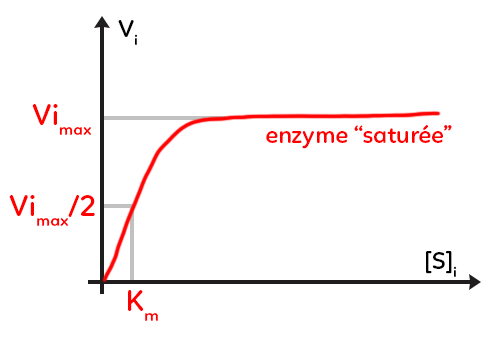
III. Vitesse initiale de la catalyse en fonction de la concentration initiale en substrat
On voit la vitesse initiale de la catalyse en fonction de la concentration initiale en substrat et cette fois, on est pour une concentration d’enzyme constante.
On voit une courbe croissante au départ puis horizontale, stable. Ainsi, si on augmente la concentration en substrat pour une quantité d’enzyme donnée, dans un premier temps la vitesse initiale va augmenter (on utilise au mieux l’ensemble des molécules d’enzymes disponibles). En revanche, au delà d’un certain seuil, augmenter encore la concentration initiale de substrat ne permet plus de faire augmenter la vitesse initiale.
À ce stade, on parle de vitesse initiale maximale, elle est caractéristique de l’enzyme et on peut dire que l’enzyme est saturée, cela signifie que tous les sites actifs des molécules d’enzymes disponibles dans le milieu de réaction sont occupés. Ces sites actifs sont occupés transitoirement puisqu’ils sont occupés lorsqu’il y a complexe enzymes-substrat mais ensuite ils sont libérés et, à nouveau, ces mêmes molécules vont servir à catalyser d’autres substrats. Ainsi, lorsque l’enzyme est saturée, il n’y a plus de molécules d’enzymes disponibles et donc la vitesse initiale ne peut plus augmenter même si on rajoute du substrat.
Si on divise la vitesse initiale maximale par deux et qu’on prend la concentration initiale de substrat correspondante on obtient une constante Km, la constante de Michaelis, qui est caractéristique d’une enzyme et qui peut être utilisée dans des études un peu plus poussées de la biochimie des enzymes.