Dosage par étalonnage
Faire un dosage par étalonnage nécessite de faire une mesure indirecte, non destructible, en utilisant et en mesurant différentes grandeurs. On étudie deux types de dosage par étalonnage : le dosage à l’aide d’un spectrophotomètre et le dosage à l’aide d’un conductimètre.
Dosage à l’aide d’un spectrophotomètre
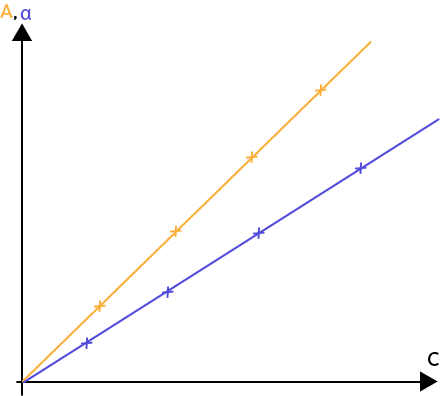
Pour le dosage à l’aide d’un spectrophotomètre, la grandeur mesurée par celui-ci est l’absorbance $A.$
Quelle est la formule de l’absorbance ?
L’absorbance $A$ est définie par la loi de Beer-Lambert. L’absorbance est proportionnelle à la concentration : $A = k\times C$.
Le coefficient de proportionnalité dépend de plusieurs choses : types de spectrophotomètre, longueur de la cuve, etc. L’absorbance est sans unité, la concentration est en mol.L-1.
Comment dose-t-on une solution, par étalonnage, à l’aide de l’absorbance ?
Si on trace l’absorbance en fonction de la concentration, comme c’est proportionnel on a une droite qui passe par l’origine.
Si la concentration est égale à zéro, l’absorbance aussi. Il faut mesurer l’absorbance d’un certain nombre de solutions connues, dont on connaît la concentration. On mesure ensuite l’absorbance de cette solution inconnue, et, grâce à une droite d’étalonnage, par correspondance, on peut trouver la concentration de la solution inconnue.
Dosage à l’aide d’un conductimètre
On utilise un conductimètre pour mesurer la conductivité $σ$ définie par la loi de Kohlrausch : $ σ = k\times C$ qui est aussi une loi de proportionnalité. Si on trace $σ$ en fonction de la concentration, on a aussi une droite qui passe par l’origine. Si on veut connaître la concentration d’une solution inconnue, on mesure la conductivité $σ$ et on peut en déduire, par rapport à la droite d’étalonnage, la concentration de la solution inconnue.
Quelles sont les limites ?
Les limites, dans les deux cas, sont que cela ne fonctionne pas pour des solutions trop concentrées. Si la solution est trop concentrée, l’absorbance va être trop forte et le spectrophotomètre ne va pas pouvoir capter assez de lumière. Cela pose des problèmes. Il en va de même pour la conductivité et la concentration.
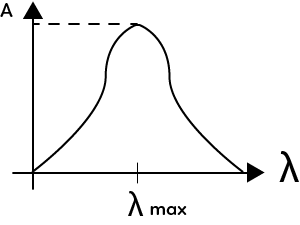
Pour le conductimètre, s’il y a d’autres ions qui sont présents dans le milieu, cela peut fausser la conductivité. Un des paramètres importants pour le spectrophotomètre, est de savoir à quelle longueur d’onde on se place pour régler le spectrophotomètre, pour mesurer l’absorbance. On se place toujours au maximum d’absorbance de la solution. Si on trace le graphe de l’absorbance de la solution en fonction de la longueur d’onde, l’absorbance de la solution va varier en fonction de la longueur d’onde.
Il faut donc se mettre à la longueur d’onde $λ_{max}$ pour une absorbance maximale.
Les applications de ces deux types de dosages
On peut demander d’utiliser ces droites d’étalonnage en utilisant l’absorbance ou la conductivité et de retrouver la concentration. On peut aussi demander de réfléchir sur les paramètres importants : la longueur d’onde choisie pour l’absorbance, les ions qui vont fausser la conductivité. Ce qui est important, ce sont également les capacités expérimentales. On peut demander de réfléchir sur un protocole où l’on va utiliser soit le spectrophotomètre soit le conductimètre.
ECE - Préparations de solutions
Qu’est-ce qu’une solution ?
Une solution correspond au mélange d’un soluté dans un solvant, et si le solvant est l’eau on parle de solution aqueuse. Il est possible de préparer une solution par dissolution et par dilution.
I. La dissolution
Sous quelle forme est le soluté d’une dissolution ?
De manière générale, en dissolution, le soluté est sous forme solide. On détermine, dans un premier temps, la masse de soluté que l’on va mesurer à l’aide d’une balance électronique.
Au cours de l’utilisation d’une balance électronique, il est primordial de penser à la fonction TARE de la balance qui permet de s’affranchir de la masse de la coupelle de pesée. Un fois la masse de solide pesée on l’introduit dans une fiole jaugée de volume correspondant au volume de la solution désirée. Pour remplir la fiole, il est fortement recommandé d’utiliser un entonnoir, qu’il faudra rincer ainsi que la coupelle un fois le solide introduit. Ensuite, remplir la fiole jaugée aux trois-quart, la boucher à l’aide d’un bouchon (surtout pas avec les doigts) et homogénéiser lentement jusqu’à la dissolution totale du soluté dans le solvant.
Enfin, compléter avec de l’eau distillé (ou le solvant de manière générale) jusqu’au trait de jauge. Pour ce faire, placer son oeil en face du trait de jauge de manière à ne voir qu’un seul trait et compléter avec de l’eau distillée jusqu’à ce que le bas du ménisque soit au niveau de la graduation, donc du trait de jauge. Si le trait de jauge est dépassé, il est obligatoire recommencer depuis le début, car enlever le surplus de solution changerait la concentration.
II. La dilution
Quel est le principe de la dilution ?
Le principe de la dilution est de partir d’un solution très concentrée qu’on appelle solution mère, et de rajouter du solvant pour obtenir une solution fille moins concentrée. On note :
$C_m$ la concentration de la solution mère,
$V_m$ le volume de solution mère à prélever pour faire la dilution,
$C_f$ la concentration de la solution fille,
$V_f$ le volume finale de la solution fille désirée.
Règle de dilution
S’il faut diluer $n$ fois la solution mère, il faut prélever un volume de la solution mère : $V_m=\dfrac{V_f}{n}$
Par exemple, si on veut obtenir un volume de solution fille égal à $V_f=50\,mL$ en sachant qu’on a dilué 10 fois la solution mère, on doit prélever $V_m=\dfrac{50}{10}=5\,mL$
Une fois la solution fille préparée, la concentration de la solution fille sera $C_f=\dfrac{C_m}{n}$
Revenons sur l’exemple : si $C_m=0,5\,mol.L^{-1}$, alors $C_f=\dfrac{0,5}{10}=0,05\,mol.L^{-1}$
Pour réaliser une dilution, il faut utiliser une pipette jaugée pour prélever la solution mère, avec une propipette et une fiole jaugée qui correspond au volume de la solution fille. Pour utiliser une pipette jaugée, deux cas de figures sont possibles :
– Si la pipette contient deux traits, il faut faire monter la solution jusqu’au trait du haut puis la faire descendre jusqu’au trait du bas.
– Si la pipette ne comporte qu’un seul trait, il faut faire monter la solution au trait du haut puis la vider entièrement.
La première chose à faire lorsque l’on utilise une pipette graduée, est de la rincer avec la solution utilisée (la solution mère), on utilise ensuite une propipette pour faire monter et descendre le liquide. Il faut bien positionner la pipette jaugée par rapport au bécher : la pipette droite et le bécher incliné à 45°. On prélève la solution, on la place dans la fiole jaugée, on rajoute de l’eau distillée, on homogénéise et enfin on rajoute de l’eau distillée jusqu’au trait de jauge.