Une application : la distillation fractionnée
Ce cours du chapitre Constitution et transformations de la matière traite de la synthèse organique de composés chimiques. Il aborde la distillation fractionnée. Puis, les dispositifs expérimentaux (chauffage à reflux, chromatographie, filtration, recristallisation). Et, le rendement d’une synthèse.
Une application, la distillation fractionnée : ce que tu vas réviser
Voici une application des relations entre structure et propriétés des alcools et des alcanes : la distillation fractionnée. Il faut savoir réaliser au laboratoire une distillation fractionnée et pouvoir expliquer son fonctionnement.
I. Le montage
Le montage à effectuer au laboratoire est le suivant :
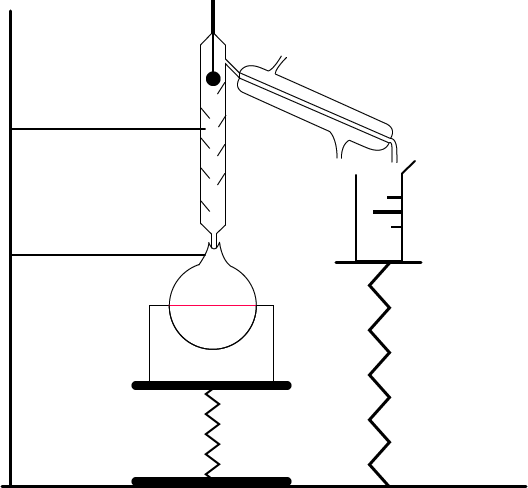
Le matériel à utiliser : un chauffe-ballon, un ballon, une colonne de Vigreux, un thermomètre (au-dessus de la colonne), un réfrigérant droit avec l’eau qui arrive par en bas et qui ressort par en haut, une éprouvette graduée (ou un bécher, un erlenmeyer, etc.).
Ne pas oublier de dessiner les supports ainsi que la potence pour que le matériel ne soit pas en lévitation sur le schéma.
II. Le mélange
Quel est le principe de la distillation fractionnée ?
La distillation consiste à séparer les différents constituants d’un mélange.
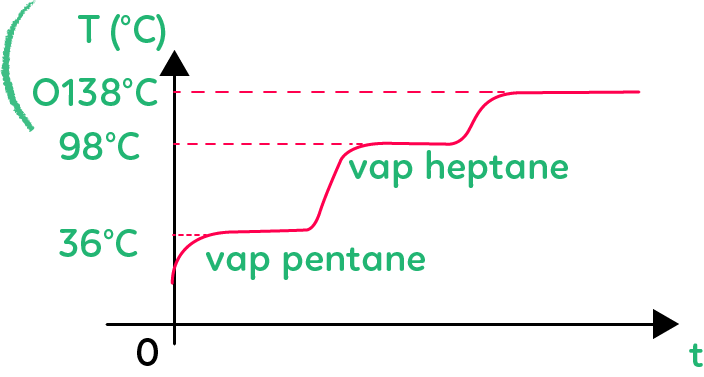
On place dans le ballon un mélange de trois espèces chimiques : le pentane qui a une température d’ébullition de 36 °C, le pentanol qui a une température d’ébullition de 138 °C et l’heptane qui a une température d’ébullition de 98 °C.
Pour séparer ces trois espèces, on joue sur les températures d’ébullition. On chauffe le mélange dans le ballon, et la première espèce qui va partir est l’espèce à la température d’ébullition la plus basse, on parle de l’espèce la plus volatile, qui est ici le pentane. On mesure cela en haut de la colonne de Vigreux.
On obtient la température en fonction du temps tracé sur ce graphique. On rappelle que la température peut être notée $T$ ou $Θ,$ en précisant bien l’unité.
On utilise des éprouvettes graduées différentes pour recueillir les espèces puisque notre but est de séparer les espèces chimiques.
1. Étape 1
La température augmente, on atteint la température de 36 °C. À ce moment-là, le pentane passe de l’état liquide à l’état gazeux et la température reste constante à 36 °C tant que le pentane est à la fois à l’état liquide et à l’état gazeux.
Puis, il y a la vaporisation ou l’ébullition du pentane. Le pentane passe à l’état gazeux et monte dans la colonne, passe par le réfrigérant et on le récupère dans l’éprouvette graduée.
2. Étape 2
Une fois que tout le pentane est parti du mélange liquide et a été récupéré dans l’éprouvette graduée, la température va augmenter et va atteindre 98 °C. C’est alors la vaporisation ou ébullition de l’heptane. L’heptane passe à l’état gazeux, il monte dans la colonne, se refroidit dans le réfrigérant droit et retombe sous forme liquide dans une autre éprouvette graduée.
La température reste constante tant qu’on a de l’heptane sous forme liquide et sous forme gazeuse.
3. Étape 3
Dès que la vaporisation de l’heptane est finie, la température se remet à augmenter et on atteint un troisième pallier de température à 138 °C pour le pentanol. Le pentanol commence à partir à l’état gazeux, etc.
4. Étape 4
Si l’on veut vraiment séparer ces trois constituants, on met une première éprouvette graduée quand la température stagne à 36 °C car on sait qu’on est en train de passer de l’état liquide à l’état gazeux pour le pentane.
Dès que la température ré-augmente, on change d’éprouvette graduée. Dès que la température stagne à 98 °C, on sait qu’on est en train de passer de l’état liquide à l’état gazeux pour l’heptane et on met la deuxième éprouvette graduée. Dès que la température recommence à augmenter, on coupe le chauffage puisqu’il ne nous reste, dans le ballon, plus que le pentanol.
III. Cas de la distillation du pétrole
Comment distiller le pétrole ?
C’est une application du quotidien. Dans la distillation du pétrole, on va jouer sur le fait que les différentes espèces qui constituent le pétrole brut, ont des températures d’ébullition différentes.
On met tout le pétrole brut dans une grosse tour où la température n’est pas la même et on récupère en haut de la tour ou de la colonne les espèces les plus volatiles (celles qui ont une température d’ébullition la plus basse). On récupère en bas de la colonne ou en bas de la tour les espèces les moins volatiles (celle qui ont une température d’ébullition la plus élevée).
Ainsi, on arrive à avoir les différentes coupes d’hydrocarbures à partir du pétrole brut. Sachant que ces coupes d’hydrocarbures ont des applications différentes.
Pour aller plus loin dans Constitution et transformations de la matière
Après avoir étudié ce cours, nous te conseillons de poursuivre avec ces autres notions :
Dispositifs expérimentaux
Dispositifs expérimentaux : ce que tu vas réviser
Plusieurs dispositifs expérimentaux sont importants à connaître dans le cadre d’une synthèse organique. Quand on fait une synthèse organique, il y a différentes étapes : la transformation (on réalise la réaction), l’isolement (on isole l’espèce chimique qui nous intéresse), la purification (éventuellement) et l’identification (on vérifie que l’espèce synthétisée est celle voulue).
I. Le chauffage à reflux
Quel est l’intérêt du chauffage à reflux ?
C’est un dispositif plutôt utilisé dans l’étape de transformation chimique. Il permet de réaliser une réaction chimique à une température plus élevée que la température ambiante (ce qui accélère la réaction).
Quel est le rôle du réfrigérant à eau ? Quel est le rôle d’un réfrigérant à air ?
Il existe deux types de montage à reflux. Si la température est élevée on va plutôt utiliser un réfrigérant à eau. Pour des plus basses températures, le réfrigérant à air suffit.
Le principe du réfrigérant est de pouvoir chauffer le milieu sans qu’il y ait de pertes de matière par évaporation. Les vapeurs se liquéfient sur les parois du réfrigérant et retombent dans le milieu réactionnel.
Pour le premier montage (réfrigérant à eau) :
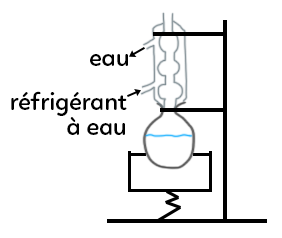
– un support élévateur (toujours présent, car cela permet de stopper la réaction ci celle-ci s’emballe),
– un chauffe ballon,
– un ballon,
– un réfrigérant à eau (l’eau arrive toujours par le bas et sort par le haut).
Pour le second montage (réfrigérant à air) :
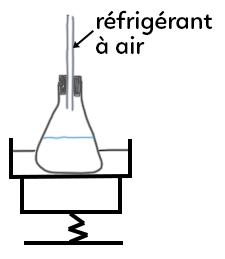
– un support élévateur,
– un dispositif de chauffage et souvent un bain marie (cristallisoir rempli d’eau),
– un erlenmeyer,
– un réfrigérant à air.
II. La chromatographie
Comment faire une chromatographie ?
La chromatographie peut se faire sur couche mince ou sur colonne. La plus connue est la chromatographie sur couche mince. C’est un processus plutôt utilisé pour l’identification des espèces mais aussi parfois pour l’isolement (chromatographie sur colonne).
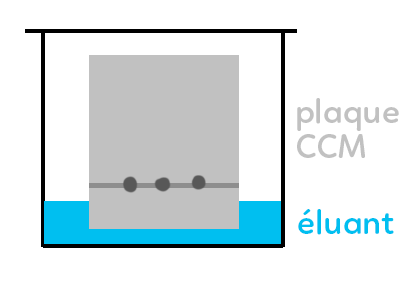
Le principe consiste à déposer sur la plaque ce qui a été synthétisé et à côté, au même niveau, le produit pur voulu et/ou des espèces parasites. La plaque est alors placée dans un éluant dont la hauteur doit être inférieure à la ligne de dépôt. L’éluant va alors monter dans la plaque par capillarité et emporter les différents produits à des vitesses variables. Deux espèces chimiques identiques se trouveront donc au même niveau sur la plaque.
Il faut toujours arrêter la progression de l’éluant lorsque celui-ci arrive à 1 cm en dessous du haut de la plaque (front d’éluant).
III. La filtration
Comment faire une filtration ?
La filtration est un dispositif expérimental qui permet d’isoler l’espèce synthétisée. La filtration consiste à séparer un liquide d’un solide. La filtration sous vide est réalisée grâce à un filtre Büchner. Cette filtration abaisse la pression à l’intérieur de l’erlenmeyer qui recevra le liquide (filtrat).

IV. La recristallisation
Comment faire une recristallisation ?
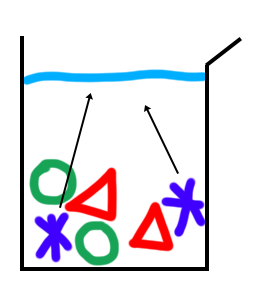
La recristallisation permet de purifier une espèce. En effet, lorsque l’on synthétise une espèce, il y a souvent des impuretés. La recristallisation permet d’enlever ces impuretés. Cela consiste à choisir un solvant dans lequel l’espèce voulue est soluble.
Par exemple, si l’on veut récupérer seulement l’espèce représentée par une étoile dans le schéma, on va choisir un solvant dans lequel les espèces « étoile » vont se dissoudre. Ensuite, on va filtrer grâce au filtre Büchner, l’espèce qui est intéressante se trouvera dans le filtrat et les impuretés dans la partie solide. Il suffit ensuite de laisser le solvant s’évaporer pour récupérer le produit de la synthèse purifié.
Pour aller plus loin dans Constitution et transformations de la matière
Après avoir étudié ce cours, nous te conseillons de poursuivre avec ces autres notions :
Rendement d’une synthèse
Rendement d’une synthèse : ce que tu vas réviser
Le rendement est une grandeur sans unité qui sert à quantifier l’efficacité d’une synthèse organique. C’est-à-dire qu’il traduit la quantité de produit effectivement obtenue par rapport à la quantité de produit idéale qu’on pourrait obtenir (« si tout se passait parfaitement bien »).
I. Formules du rendement en chimie
Il existe trois formules pour calculer le rendement qui dépendent des informations à notre disposition :
$ R = \dfrac{n_{\text{obtenu}}}{n_{\text{attendu}}} \times 100$ lorsqu’on connaît les quantités de matière obtenues et attendues ($n$ en mol) pour l’espèce chimique d’intérêt.
$ R = \dfrac{m_{\text{obtenu}}}{m_{\text{attendu}}}\times 100$ lorsqu’on connaît les masses obtenues et attendues ($m$ en kg ou en g) pour l’espèce chimique d’intérêt.
$ R = \dfrac{V_{\text{obtenu}}}{V_{\text{attendu}}}\times 100$ lorsqu’on connaît les volumes obtenus et attendus ($V$ en L ou en $\text{m}^3$) pour l’espèce chimique d’intérêt.
Les grandeurs « obtenues » sont des grandeurs expérimentales qui sont mesurées après la synthèse.
Les grandeurs « attendues » sont des grandeurs théoriques calculées à l’aide d’un tableau d’avancement dans les conditions idéales.
Les trois formules sont équivalentes.
Remarque : $0 \leq R \leq 100 \ \%$ car si la réaction se passe expérimentalement comme théoriquement on a 100 % sinon on obtient moins de produit que prévu (réaction non totale, réactions parasites, pertes, etc.) donc on est en dessous de 100 %.
II. Exemple d’un rendement de synthèse organique
Réaction entre l’acide éthanoïque $\text{CH}_3\text{COOH}$ et l’éthanol $\text{C}_2\text{H}_5\text{OH}$ pour former de l’éthanoate d’éthyle $\text{CH}_3\text{COOC}_2\text{H}_5$ et de l’eau.
Toutes les grandeurs sont en mol. On ne considérera pas la quantité d’eau car elle est le solvant.
Le réactif limitant est celui qui dont l’avancement est le plus faible donc c’est $\text{CH}_3\text{COOH}$. Ainsi à la fin de la réaction $x=0{,}20 \ \text{mol}$ et $n_{\text{attendu}}=x=0{,}20 \ \text{mol}$.
On donne $n_{\text{obtenu}}=0{,}12 \ \text{mol}$.
On peut donc calculer le rendement :
$ R = \dfrac{n_{\text{obtenu}}}{n_{\text{attendu}}} \times 100=\dfrac{0{,}12}{0{,}20} \times 100 = 60 \ \%$
Cela signifie qu’en faisant la réaction on n’a obtenu que 60 % de la quantité idéale attendue.
Pour aller plus loin dans Constitution et transformations de la matière
Après avoir étudié ce cours, nous te conseillons de poursuivre avec ces autres notions :


