Atomes et ions
Atomes et ions
La matière est constituée de tous petits grains de matière appelés les atomes.
I. Atomes
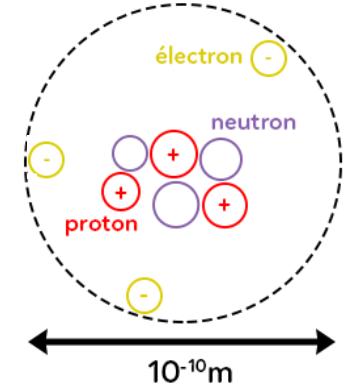
Les atomes sont eux-mêmes constitués d’un noyau, constitué de protons, chargés positivement, et de neutrons de charge nulle. Autour de ce noyau sont en mouvement des électrons, chargés négativement. La frontière de l’atome est ici représentée en pointillés et pour les dimensions de l’atome, on a environ un ordre de grandeur de 10-10 m. Ce sont des objets de très petites tailles.
Comment passe-t-on des atomes aux ions ?
II. Ions
Un ion est un atome qui a gagné ou perdu des électrons.
Exemple de l’atome de fluor
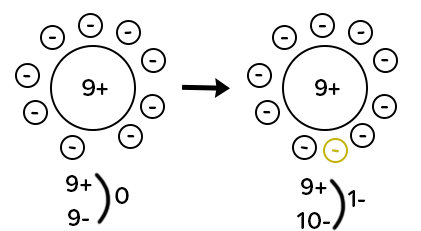
L’atome de fluor est représenté avec neuf charges positives dans son noyau (neuf protons), et neuf électrons en mouvement autour du noyau. Au niveau de la charge, on a neuf charges positives, neuf charges négatives donc on a une charge globale égale à zéro puisque tous les « plus » s’annulent avec les « moins ». C’est le cas de tous les atomes : ils sont dits électriquement neutres.
Si maintenant le fluor gagne un électron, on a un électron excédentaire. Donc on obtient neuf charges positives dans le noyau et dix charges positives autour du noyau. Il y a une charge négative excédentaire. On note l’ion qui a été obtenu : F– (la charge négative excédentaire notée en exposant). Les ions chargés négativement sont appelés les anions. Pour passer d’un atome à un anion, il faut gagner des électrons.
Exemple de l’atome de béryllium
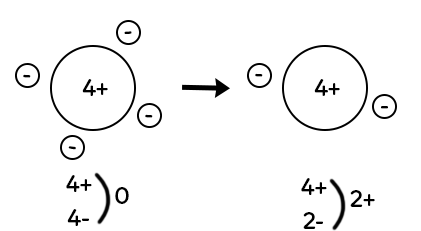
L’atome de béryllium a quatre charges positives dans son noyau et quatre électrons autour du noyau (quatre charges négatives). L’atome de béryllium, comme tous les atomes est électriquement neutre.
Si on enlève deux électrons, il ne reste plus que deux électrons autour du noyau de l’atome de béryllium. On a quatre charges positives dans le noyau et deux charges négatives autour du noyau, ce qui donne deux charges positives excédentaires. On note cet ion : Be2+ (deux charges plus excédentaires notées en exposant). Pour passer d’un atome à un ion chargé positivement, il faut une perte d’électrons. Les ions chargés positivement sont eux appelés cations.
Atomes et molécules
Atomes et molécules
Dans ce cours, nous étudions la notion d’atome et de molécule et les représentations des atomes et des molécules courantes. La matière est constituée de petits grains de matière appelés les atomes.
I. Atomes
Il existe une centaine d’atomes différents et chaque atome porte un nom, a un symbole et un modèle moléculaire. Il faut connaître le symbole et le modèle moléculaire des quatre atomes les plus courants :
Hydrogène
Son symbole est H, qui correspond à la première lettre de son nom. Son modèle est une sphère blanche.
Carbone
Son symbole est C, la première lettre de son nom. Son modèle est une sphère noire.
Oxygène
Son symbole est O, la première lettre de son nom. Son modèle est une sphère rouge.
Azote
Son symbole est N, c’est le seul pour lequel son symbole ne correspond pas à la première lettre de son nom. Son modèle est une sphère bleue.
II. Molécules
Une molécule est un ensemble d’atomes liés entre eux. Voyons le modèle des molécules, et comment, à partir du modèle, établir la formule chimique des molécules.
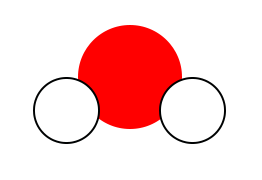
Le premier modèle est la molécule d’eau. On constate qu’elle a un atome d’oxygène et deux atomes d’hydrogène. Pour la formule, on va donc écrire le symbole des deux atomes présents : HO (par ordre alphabétique). On a deux hydrogènes donc on va préciser en indice, en bas à droite du H, le chiffre 2. On a qu’un seul atome d’oxygène : on ne l’écrit pas en indice car c’est sous-entendu qu’il n’y a qu’un seul atome. Molécule d’eau = H2O
Le deuxième modèle est celui du méthane. On a la formule et on va représenter le modèle moléculaire. Dans la formule, on a CH4. On a donc un seul atome de carbone (aucun chiffre indiqué) et quatre atomes d’hydrogène. On va alors la représenter comme ceci :
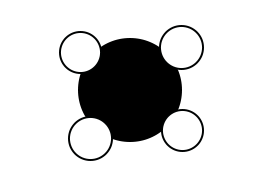
Un atome de carbone au centre et quatre molécules d’hydrogène de part et d’autre de l’atome de carbone, de façon symétrique.
Précision : les atomes d’hydrogène sont, dans les représentations, plus petits que les atomes de carbone, d’hydrogène et d’azote qui sont, eux, à peu près de la même taille.
Le noyau de l'atome
I. Constitution
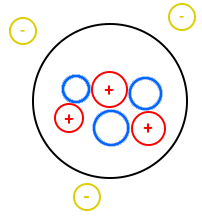
On a représenté un atome. Un atome est constitué d’un noyau et d’électrons (en jaune) en mouvement autour du noyau. Dans le noyau de l’atome, il y a des sphères qui représentent les nucléons. Parmi ces nucléons, il y en existe deux types :
– Ceux représentés en bleu : les neutrons (ayant une charge nulle d’où le nom neutron).
– Ceux représentés en rouge avec un « + » : les protons, chargés positivement.
II. Représentation
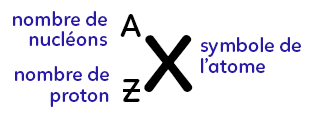
Cas général : on met X le symbole de l’atome (la première lettre ou les deux premières lettres de son nom). Ensuite, on inscrit deux nombres : en bas, le nombre de protons (Z) et en haut, le nombre de nucléons (A). Attention, A est bien le nombre de nucléons et non de neutrons !

Prenons l’exemple représenté ci-dessus, il s’agit du noyau d’atome de lithium, de symbole Li. On a trois protons : on inscrit le chiffre trois en bas. On a sept nucléons: on inscrit sept en haut.
Si on a cette représentation de l’atome et que l’on veut savoir sa composition : 3 est le nombre de protons et pour avoir le nombre de neutrons on fait 7 – 3 = 4, on retrouve bien quatre neutrons pour le noyau de lithium.
III. Isotopes
Voyons qu’on l’on appelle des noyaux d’atomes isotopes. Les deux noyaux d’atomes représentés ci-dessous sont des noyaux isotopes.
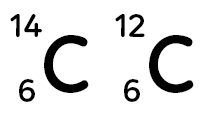
Celui de gauche s’appelle le carbone 14 et celui de droite, le carbone 12.
Voyons leur constitution pour étudier les points communs et différences entre ces deux noyaux d’atomes. Pour les deux noyaux, le nombre de protons est de six. Pour avoir le nombre de neutrons, on sait qu’il faut faire la différence entre le nombre d’en haut et le nombre d’en bas. Pour le carbone 14, on a 14 – 6 = 8 neutrons. Pour le carbone 12, on a 12 – 6 = 6 neutrons. Le nombre de nucléons est le nombre inscrit en haut. C’est donc 14 pour le carbone 14 et 12 pour le carbone 12. On constate que deux noyaux d’atomes isotopes ont le même nombre de protons, ils ont le même nom mais ils ont un nombre de neutrons et de nucléons différent.


